- Телефон: +7 (495) 258-83-05
- E-mail: sales@electrochemistry.ru
Электроды для потенциометрического титрования
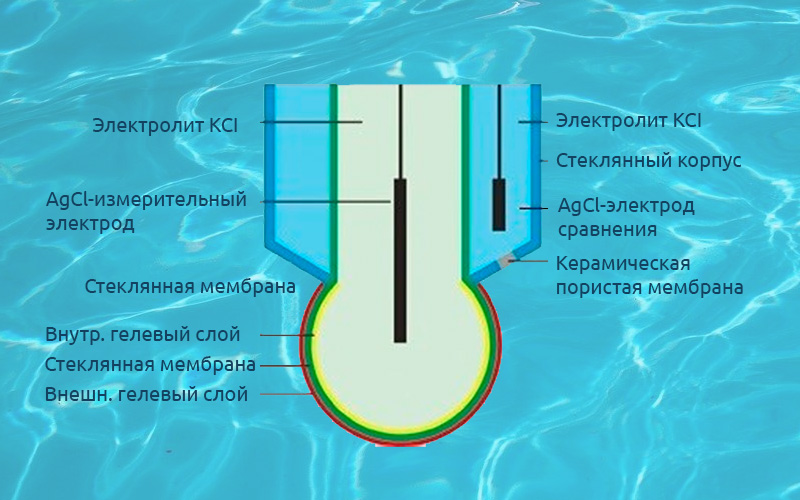
В качестве измерительной системы в потенциометрическом титровании выступают индикаторный электрод и электрод сравнения. Среди последних особо стоит остановиться на хлорсеребряном (ХСЭ) и каломельном электродах, состоящих из серебра или ртути, покрытых малорастворимыми хлоридами этих металлов и погруженных в раствор растворимых хлоридов (KCl, NaCl). На поверхности происходят обратимые реакции:
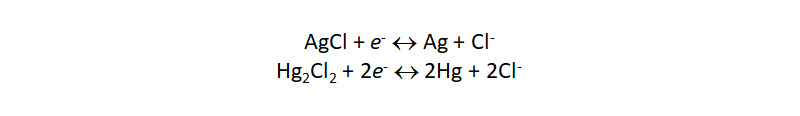
Они приводят к хорошо воспроизводимому, стабильному во времени и мало зависящему от внешних условий электродному потенциалу. В связи с токсичностью жидкой ртути каломельный электрод нашел применение в первую очередь в научных исследованиях, тогда как ХСЭ безальтернативен для рутинного потенциометрического анализа. Выпускаемые промышленностью ХСЭ имеют заполненный референтным электролитом (3 М KCl) стеклянный корпус, сообщающийся с анализируемым раствором через пористую диафрагму.
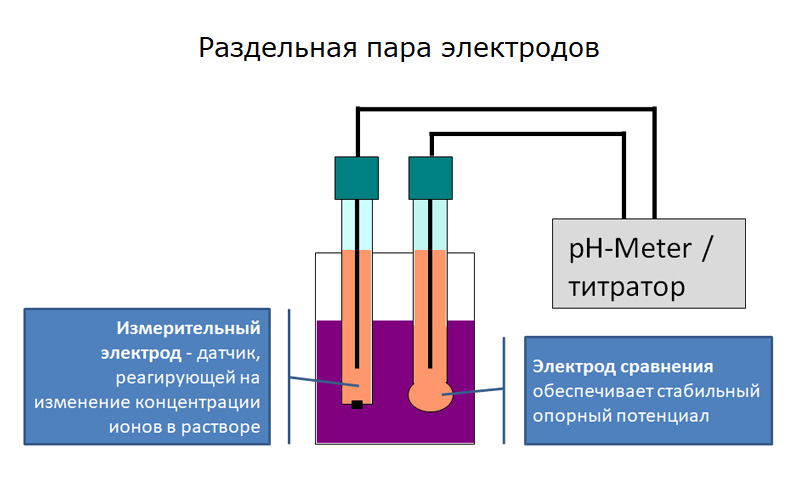
Рис. 1. Устройство раздельной пары электродов
Пожалуй, наиболее распространенным из индикаторных электродов в потенциометрическом титровании является стеклянный pH-электрод, состоящий из ХСЭ, заключенного в заполненную 0,1 М HCl оболочку с наконечником в виде тонкой мембраны из специального стекла с ионной проводимостью. Потенциал такого электрода изменяется линейно с pH-раствора:
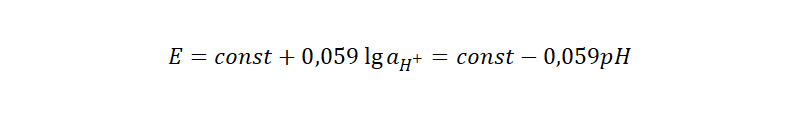
Стеклянный электрод часто конструктивно объединяют с электродом сравнения в виде комбинированного электрода как показано на рис. 3, когда в одном корпусе смонтированы внутренний и внешний ХСЕ. Комбинированные электроды надежны и удобны в работе и вытеснили раздельную пару электродов в большинстве задач. Вместе с тем, в некоторых случаях наличие диафрагмы между внешним ХСЕ и анализируемым раствором может приводить к возникновению неконтролируемой разности потенциалов (т.н. «потенциал Доннана»), что выражается в нестабильных показаниях и длительном времени отклика измерительной системы.
Появлению потенциала Доннана способствуют:
-
растворы с очень низкой электропроводностью;
-
засорение диафрагмы осадками;
-
разрушение диафрагмы в сильных кислотах и щелочах;
-
коллоидная среда с дисперсной фазой.
В подобных ситуациях, когда требуется частое восстановление или даже замена диафрагмы, измерительный электрод и электрод сравнения объединять нецелесообразно. Раздельная пара электродов преимущественно рекомендуется для неводных сред, например, при потенциометрическом определении числа нейтрализации нефтепродуктов и смазочных материалов по ГОСТ 11362-96, хотя более новые стандарты (ASTM D4739-2017) допускают использование для этой цели комбинированных pH-электродов с улучшенными характеристиками.
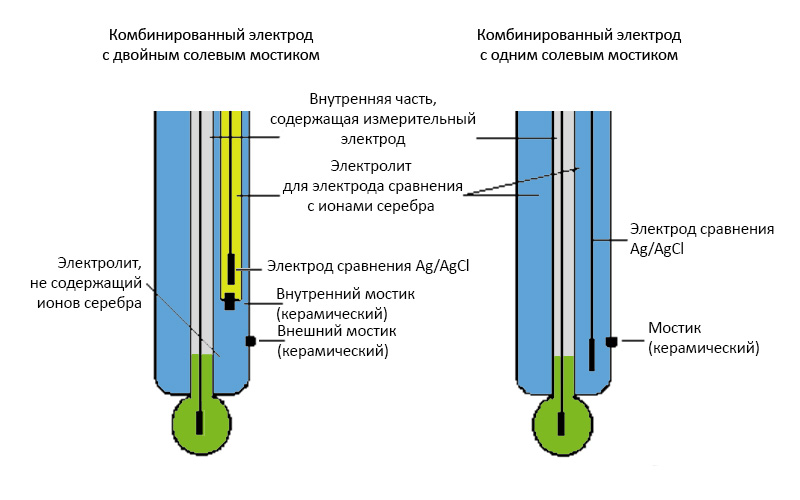
Рис. 2. Конструкция комбинированного стеклянного pH-электрода
Типы электродов для потенциометрического титрования
Все многообразие индикаторных электродов для различных видов потенциометрического титрования можно условно разделить на два класса и несколько основных типов:
-
Металлические:
-
металл/растворимая соль;
-
металл/малорастворимая соль, комплекс;
-
инертные.
-
Ионоселективные (мембранные):
-
стеклянные;
-
кристаллическая мембрана;
-
жидкая мембрана.
Также заслуживают упоминания т.н. «газовые» электроды для детектирования O2, NH3, CO2, представляющие собой металлический или pH-электрод в окружении мембраны из гидрофобного газопроницаемого полимера. Остановимся на различных типах электродов более подробно.
Металл/растворимая соль
Металл находится в равновесии со своими ионами в растворе:По причине неустойчивости в кислых средах в присутствии кислорода, а также низкой селективности данный тип электродов не нашел аналитического применения для большинства металлов за несколькими важными исключениями. В частности, серебряный электрод широко используется для регистрации конечной точки в аргентометрии – осадительном титровании с катионами серебра.
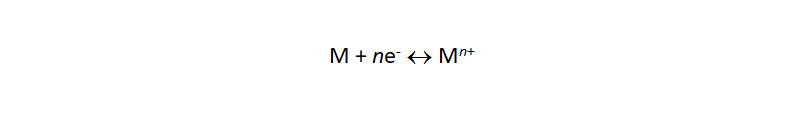
По причине неустойчивости в кислых средах в присутствии кислорода, а также низкой селективности данный тип электродов не нашел аналитического применения для большинства металлов за несколькими важными исключениями. В частности, серебряный электрод широко используется для регистрации конечной точки в аргентометрии – осадительном титровании с катионами серебра.
Металл/малорастворимая соль, комплекс
Потенциал электрода зависит от активности анионов, образующих с катионами металла осадок соли или комплексного соединения:
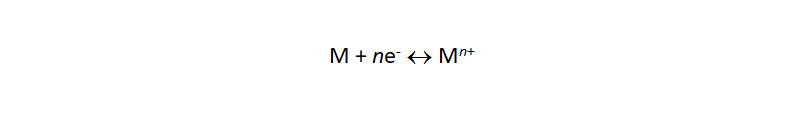
По причине неустойчивости в кислых средах в присутствии кислорода, а также низкой селективности данный тип электродов не нашел аналитического применения для большинства металлов за несколькими важными исключениями. В частности, серебряный электрод широко используется для регистрации конечной точки в аргентометрии – осадительном титровании с катионами серебра.
Металл/малорастворимая соль, комплексПотенциал электрода зависит от активности анионов, образующих с катионами металла осадок соли или комплексного соединения:
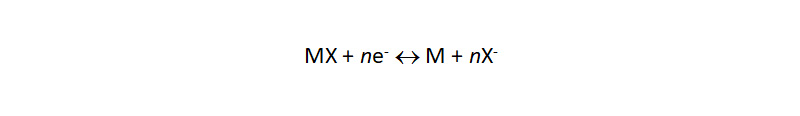
К таким электродам относятся рассмотренные выше хлорсеребряный и каломельный. Еще одним примером служит электрод Hg2ЭДТА2-/Hg, который может заменять традиционные цветные индикаторы в трилонометрии.
Инертные
Функция электродов из Pt, Au или Pd заключается в транспорте электронов для протекающих на их поверхности окислительно-восстановительных (RedOx) реакций между растворимыми формами определяемого вещества с различной степенью окисления:
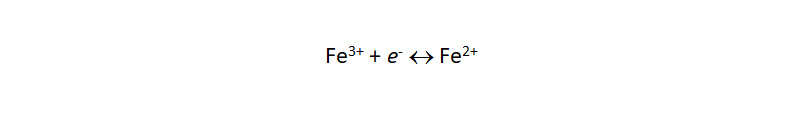
Инертные металлические электроды позволяют осуществлять различные виды окислительно-восстановительного титрования (хроматометрия, перманганатометрия и др.), в том числе, при мешающем влиянии окрашенных и мутных сред.
Стеклянные
В отличие от металлических электродов, на поверхности мембраны не протекают окислительно-восстановительные процессы; она создает контактную разность потенциалов между электродами сравнения, погруженными в анализируемый и референтный растворы с переменной и постоянной активностью определяемого вещества, соответственно:
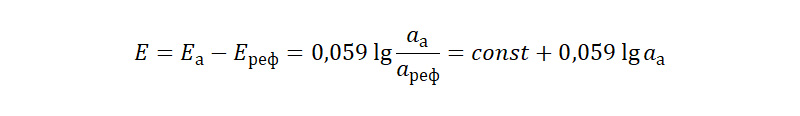
По аналогии с pH, диапазон измерения всех ионоселективных электродов удобно выражать через показатель pM или pX – отрицательный логарифм активности определяемых катионов или анионов.
Идеальная мембрана для ионоселективного электрода должна обладать следующими характеристиками: низкая растворимость в анализируемой среде, достаточная ионная проводимость, высокая селективность по отношению к анализируемому веществу. Всем этим условиям отвечают тонкие (0,2 мм) пленки из особого сорта гигроскопичного стекла, впервые предложенного компанией Корнинг. Стеклянные электроды незаменимы при измерении pH и проведении кислотно-основного титрования в водных и неводных средах. Введением в состав стекла оксидов бора и алюминия получаются электроды, чувствительные к однозарядным катионам: Na+, K+, NH4+, Rb+, Cs+, Li+, Ag+.
Кристаллическая мембранаМембрана имеет толщину 1–2 мм и представляет собой смесь твердых электролитов или монокристалл соли с ионной проводимость, обеспечиваемой дефектами кристаллической решетки. В силу строго определенного размера вакансий в структуре кристалла подвижностью обладает только один тип ионов, что гарантирует высокую селективность этих электродов. Ионоселективный электрод с мембраной из LaF3 с примесью EuF2 прочно вошел в практику измерения концентрации фторид-ионов. Существуют электроды для ряда других анионов: Cl-, Br-, I-, CN-, SCN-, S2-, а также некоторых катионов: Ag+, Cu2+, Zn2+, Cd2+.
Кристаллическая мембрана
Контактный потенциал между анализируемым и референтным растворами создается за счет текучего органического материала с ионообменными свойствами. Электроды с жидкой мембраной чаще всего обратимы по отношению к сложным анионам (BF4-, NO3-, ClO4-) и многозарядным катионам (Ca2+, Mg2+).
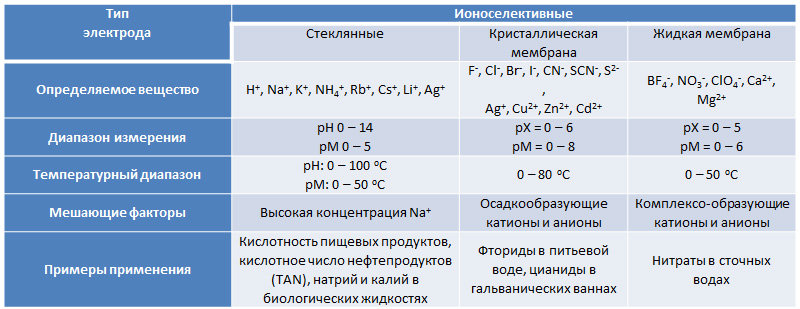
Табл. 1. Ионоселективные электроды для потенциометрического титрования
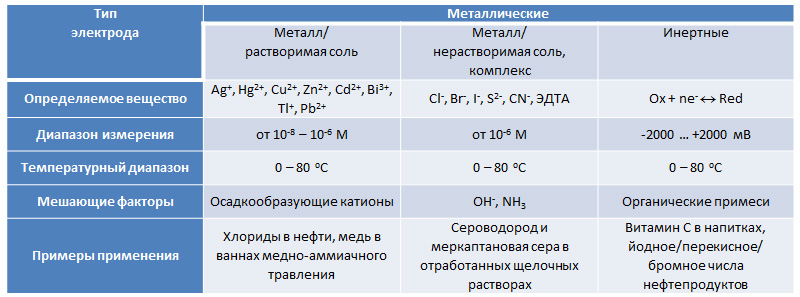
Табл. 2. Металлические электроды для потенциометрического титрования





