- Телефон: +7 (495) 258-83-05
- E-mail: sales@electrochemistry.ru
Базовые понятия в титриметрии: кривые титрования, скачок титрования, точка эквивалентности, конечная точка титрования
Что такое точка эквивалентности
Титрование представляет собой процесс постепенного добавления раствора известной концентрации к раствору, концентрацию которого требуется определить. Ключевым моментом в титровании будет фиксирование точки, в которой количество добавленных активных частиц титранта сравняется с количеством реагирующих частиц в титруемом растворе.
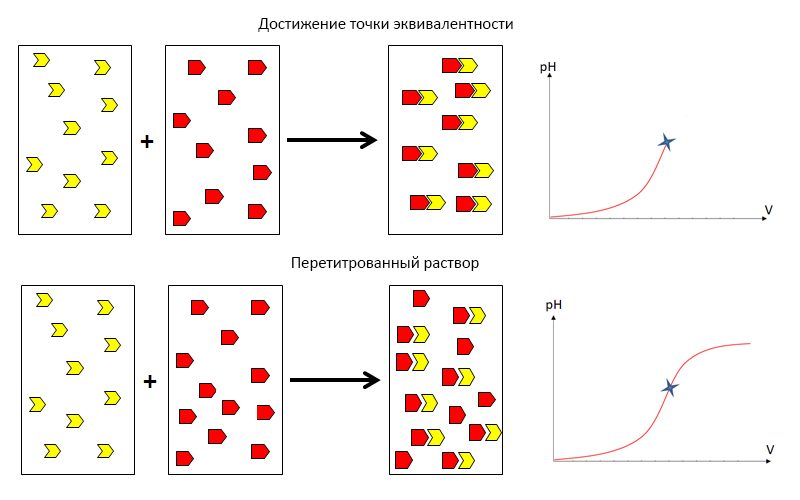
Рис.1. Стадии титрования
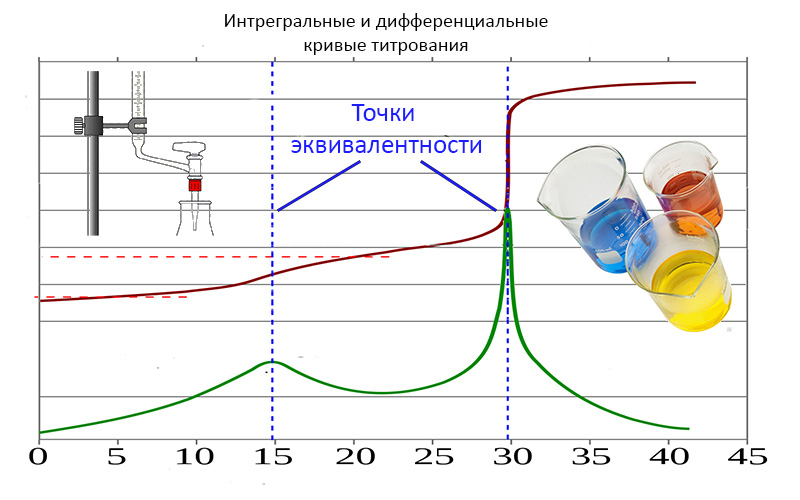
В этом случае количество взаимодействующих частиц в титруемом растворе будет эквивалентным, а само состояние системы в этот момент называют точкой эквивалентности (ТЭ).
Как визуально определить точку эквивалентности
При ручном титровании момент достижения точки эквивалентности определяется по изменению окраса титруемого раствора, появлению осадка, другим явно наблюдаемым признакам. Однако если исходные компоненты бесцветные и их смешение не сопровождается внешними проявлениями, то к определяемому веществу добавляют специальный реактив – индикатор титрования, который реагирует на изменения свойств раствора, меняя окраску, что позволяет обнаружить ТЭ.
Индикаторы – это вещества, способные обратимо изменять свою окраску в зависимости от текущего состояния системы. К значимым характеристикам раствора, которые можно отслеживать в присутствии индикаторов относятся: значение pH, наличие определенных катионов или анионов, способность компонентов раствора к комплексообразованию.
Обычно изменение цветности раствора при достижении точки эквивалентности происходит с некоторым опозданием. Этот момент называется точкой конца титрования (ТКТ), которая не всегда совпадает с точкой эквивалентности. Чем больше различие между ТКТ и ТЭ, тем больше ошибка метода. Поэтому выбор индикатора, который позволит зафиксировать конечную точку титрования максимально близко к точке эквивалентности, является важнейшей задачей при создании методики ручного титрования.
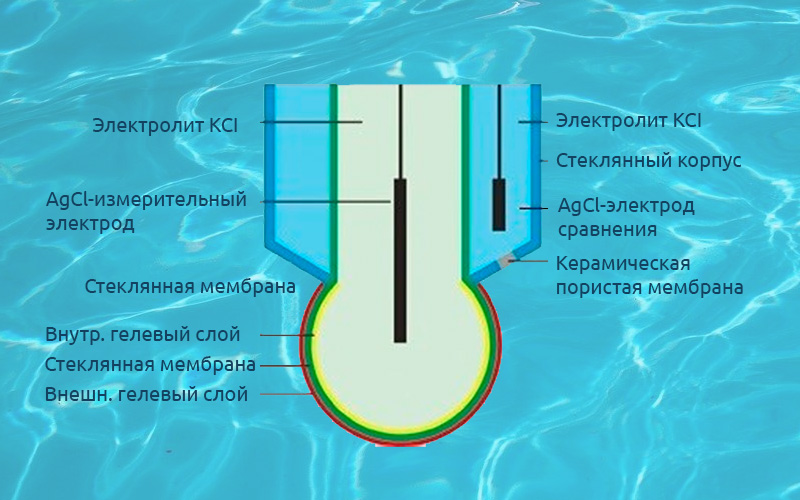
Чтобы понять, какие индикаторы будут оптимальны в каждом отдельном случае, нужно знать условия изменения окраса индикатора и сопоставить их с интервалом скачка титрования, в котором лежит точка эквивалентности. При разработке метода титрования строят теоретические кривые, по которым можно подобрать подходящий индикатор, оценив поведение системы: анализируемый раствор-титрант.
Так, например, при титровании раствора соляной кислоты раствором щелочи точка эквивалентности наступает в момент нейтрализации титруемого раствора, соответственно при рН=7. В кислотно-основном титровании применяется большое разнообразие индикаторов, изменяющих свой окрас в зависимости от pH среды.

Рис. 2. Шкала изменения окраса индикатора бромтимоловый синий в зависимости от pH.
Для приведенного примера лучше всего использовать индикатор бромтимоловый синий. Он начинает резко изменять свой окрас при рН 7,3 (показатель pT), а интервал перехода окраски составляет 6,0…7,6. Видно, что точка эквивалентности (рН 7,0) также находится в этом интервале. Поскольку 7,3 больше, чем 7,0, то количество добавленного титранта при достижении конечной точки титрования будет несколько больше, чем требуется для достижения ТЭ, что приведет к ошибке титрования.
Кривые титрования
В общем случае кривая титрования показывает зависимость свойств титруемого раствора от количества добавляемого к нему титранта.
В аналитической химии кривые титрования выполняют две задачи:
-
Анализ теоретических кривых титрования позволяет подобрать правильный индикатор. В расчет берут константу равновесия реакции, протекающей в ходе титрования, а также исходные концентрации взаимодействующих веществ.
-
Экспериментальные кривые титрования позволяют определить точку эквивалентности. Для построения графика измеряют какой-то показатель, который зависит от концентрации реагентов в системе, например pH или потенциал системы.
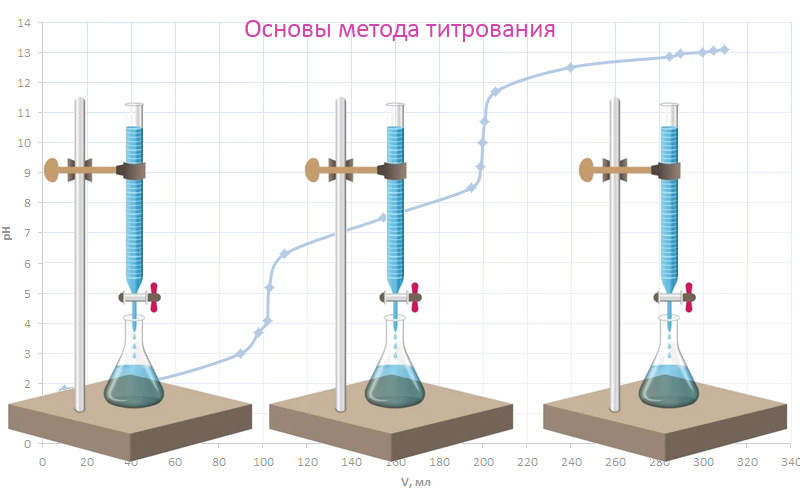
Применительно к кислотно-основному титрованию график строят в координатах pH – V и на нем будет отображаться изменение pH-раствора в процессе титрования. При построении такой интегральной кривой титрования в точке эквивалентности будет наблюдаться резкое изменение pH, которое называют скачком титрования. Наблюдаемые перегибы вблизи точки эквивалентности называются началом и концом скачка на кривой титрования.
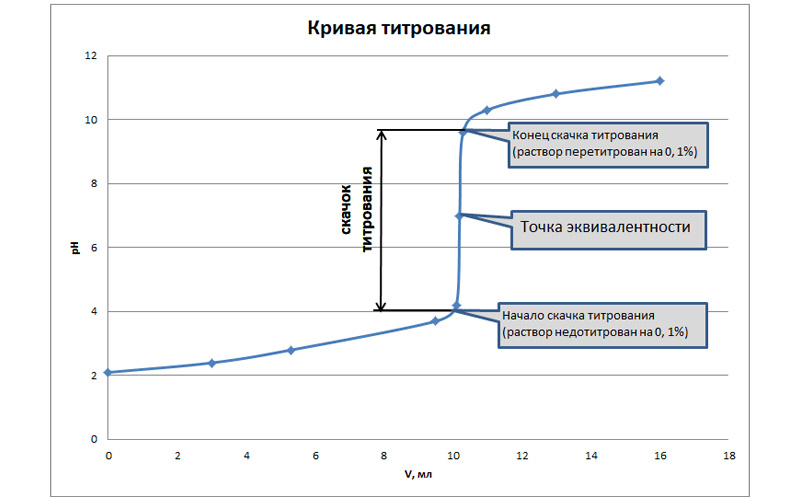
Рис. 3. График интегральной кривой кислотно-основного титрования
В зависимости от силы реагирующих кислот и оснований, вид кривой титрования будет меняться. При взаимодействии близких по силе сильных кислот и щелочей величина скачка титрования будет составлять порядка 5-6 единиц на шкале pH. Если силы определяемого раствора и титранта различаются, то размер вертикального участка будет сокращаться, а для многоосновных кислот скачков титрования на кривой будет несколько. Это необходимо учитывать при подборе индикатора. Если скачок на интегральной кривой слабо заметен, то имеет смысл построить дифференциальную кривую титрования, которая позволит определить экстремум и рассчитать точку эквивалентности более точно. Такой подход практикуется в потенциометрическом титровании, где расчет и построение кривых происходит автоматически в электронном блоке титратора.