- Телефон: +7 (495) 258-83-05
- E-mail: sales@electrochemistry.ru
Основные методы титриметрического анализа

В основе титриметрического анализа лежит химическое взаимодействие между титруемым раствором и добавляемым титрантом. Рабочий раствор подбирают таким образом, чтобы реакция протекала количественно.
Химические реакции в титриметрическом анализе
Химические процессы, которые лежат в основе взаимодействия между титрантом и определяемым веществом, могут иметь различную природу. Наиболее часто встречаются:
-
реакции ионного обмена;
-
окислительно-восстановительные процессы;
Зная механизм реакции, можно посчитать ее стехиометрию, а значит определить концентрацию титруемого раствора.
Обменные реакции могут:
-
протекать с образованием малодиссоциирующих соединений (например, воды в реакциях нейтрализации);
-
сопровождаться выпадением осадка;
-
проходить с образованием комплексов.
Все эти взаимодействия должны протекать необратимо, чтобы исходные реагенты расходовались полностью. В этом случае для вычисления концентрации определяемого раствора применим закон эквивалентов.
Как контролировать точку эквивалентности в процессе титрования
В ручных методах титриметрического анализа используют особенности каждого типа реакции:
-
В осадительном (седиметрическом) титровании точку эквивалентности определяют по выпадению осадка.
-
В окислительно-восстановительном титровании подбирают индикаторы, которые меняют окраску при изменении степени окисления компонентов раствора.
-
В кислотно-основном титровании важно подобрать индикатор, который будет менять свой цвет вблизи точки эквивалентности.
-
Комплексонометрическое титрование позволяет определять содержание металлов, способных образовывать комплексы с реагентом, выступающим в качестве титранта. Эта реакция обычно также сопровождается изменением цветности раствора.
Рассмотрим несколько примеров реакций, лежащих в основе различных методов титрования.
Реакция нейтрализации. Кислотно-основное титрование.
В основе этого взаимодействия лежат реакции между кислотой и основанием. При этом сила кислоты и основания будет влиять на вид кривой титрования и расположение точки эквивалентности на ней.
При взаимодействие сильных кислот и оснований ТЭ лежит в районе нейтрального pH. Ее определение не вызывает особых сложностей, поскольку скачок титрования составляет порядка ΔрН = 5,4. В этом случае для нахождения точки эквивалентности обычно используют два распространенных индикатора: фенолфталеин или метиловый оранжевый. Их интервал перехода окраса пересекается со скачком титрования.
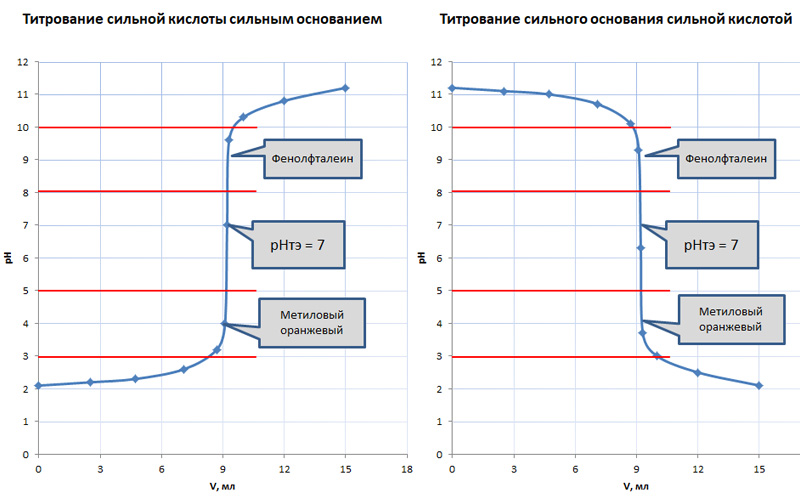
Таблица 1. Анализ кривых титрования при взаимодействии сильных кислот и оснований
| Тип взаимодействия | Титрование сильной кислоты сильным основанием | Титрование сильного основания сильной кислотой |
| Химическая реакция | HCl + NaOH = NaCl + H2O | NaOH + HCl = NaCl + H2O |
| Точка эквивалентности | рН т.э. = 7 | рН т.э. = 7 |
| Величина скачка титрования | Δ рН = 5,4 | Δ рН = 5,4 |
Если происходит взаимодействие между слабой кислотой и слабым основанием, то в этом случае вид кривой титрования меняется.
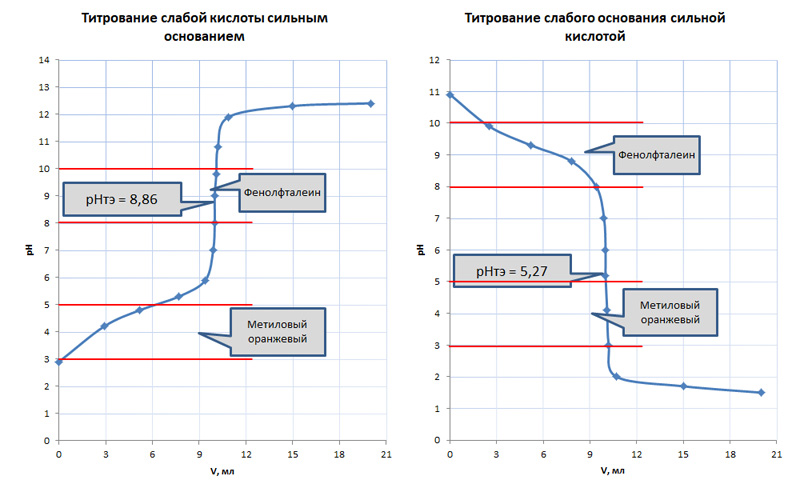
В первую очередь уменьшается скачок титрования ΔрН, а выбор индикатора будет зависеть от pH точки эквивалентности. Точка эквивалентности в этом случае не будет совпадать с точкой нейтрализации. В случае титрования слабых кислот она будет лежать в области изменения окраса фенолфталеина, а у слабых оснований ТЭ попадает в кислый диапазон, где может применяться метиловый оранжевый или метиловый красный, у которого цвет изменяется в диапазоне pH 4,4-6,2.
Таблица 2. Анализ кривых титрования при взаимодействии слабых кислот с сильными основанями и слабых оснований с сильными кислотами
| Тип взаимодействия | Титрование слабой кислоты сильным основанием | Титрование слабого основания сильной кислотой |
| Химическая реакция | CH3COOН + NaOH = CH3COONa + H2O | NaOH + HCl = NaCl + H2O |
| Точка эквивалентности | рН т.э. = 8,86 | рН т.э. = 5,27 |
| Величина скачка титрования | Δ рН = 2 | Δ рН = 2 |
Таким образом, представленные методы анализа позволяет количественно определять искомые компоненты растворов при условии правильного подбора индикатора.
При взаимодействии между собой слабых кислот и оснований в водных растворах скачок титрования будет слишком малым для идентификации, поэтому такие реакции не имеют практического смысла. Для анализа этих систем используют различные ухищрения: проводят титрование в неводных средах или вводят дополнительные комплексообразователи, которые способны разрушаться в присутствии титранта.
Титрование многоосновных кислот проходит ступенчато с постепенным замещением атомов водорода в молекуле кислоты. Скачок на первой ступени соответствует образованию однозамещенной соли, на следующем этапе уходит второй атом водорода. Замещение последнего атома водорода происходит крайне медленно и эта реакция характеризуется очень маленькой константой диссоциации (≈10-13), поэтому на кривой титрования третья ступень практически невидна. Важно отметить, что на каждой ступени титрования многоосновной кислоты необходим свой индикатор.
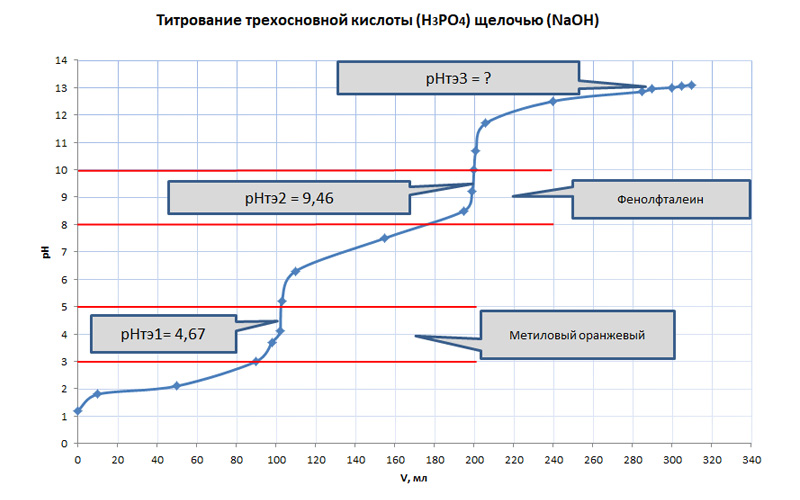
Если фосфорную кислоту необходимо оттитровать по всем трем ступеням, то в этом случае к ней добавляют известное количество раствора хлорида кальция (CaCl2). В результате реакции в осадок выпадет соль фосфорной кислоты, а в растворе остается свободная соляная кислота:
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl
Определить содержание образовавшейся HCl можно щелочным рабочим раствором, а далее вычисляется количество исходной ортофосфорной кислоты. Такой способ называется обратным титрованием.
Аналогичный подход можно применять и для количественного анализа других слабых многоосновных кислот, в том числе и органических.
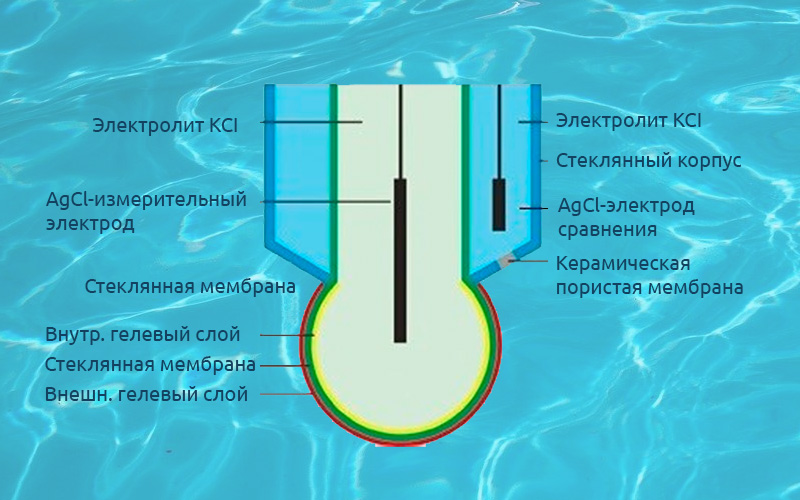
Следует отметить, что фиксация точки эквивалентности может происходить не только по изменениям окраски раствора, но и по изменениям других свойств. В потенциометрическом титровании регистрируются изменения электрохимических свойств системы по ходу взаимодействия титранта с анализируемым раствором. Этот подход позволяет автоматизировать методику титрования и избежать влияния человеческого фактора на результат анализа.