- Телефон: +7 (495) 258-83-05
- E-mail: sales@electrochemistry.ru
Что такое титрование. Определение титрования
Титриметрические методы анализа, наряду с гравиметрией, относятся к классическим химическим методам количественного анализа. Гравиметрические методы считаются более точными, однако они не отличается экспрессностью, что снижает их ценность для применения в промышленности. В ответ на реальные требования производства широкое распространение получил титриметрический анализ. По точности определения он практически не уступает гравиметрическим методам, зато сильно выигрывает по времени, затраченному на анализ пробы.
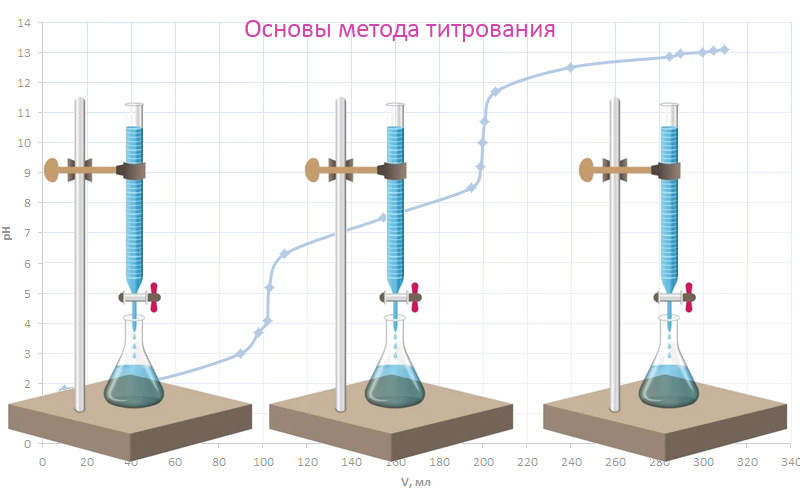
Сущность метода титрования заключается в определении точного объема реактива (титранта), вступающего в количественную реакцию с определяемым компонентом в титруемом растворе. Также известен способ весового титрования, в ходе которого определяют массу добавляемого к раствору реагента, но этот подход не получил широкого распространения.
В основе метода лежит закон эквивалентов, из которого следует, что химические вещества взаимодействуют между собой в эквивалентных соотношениях.

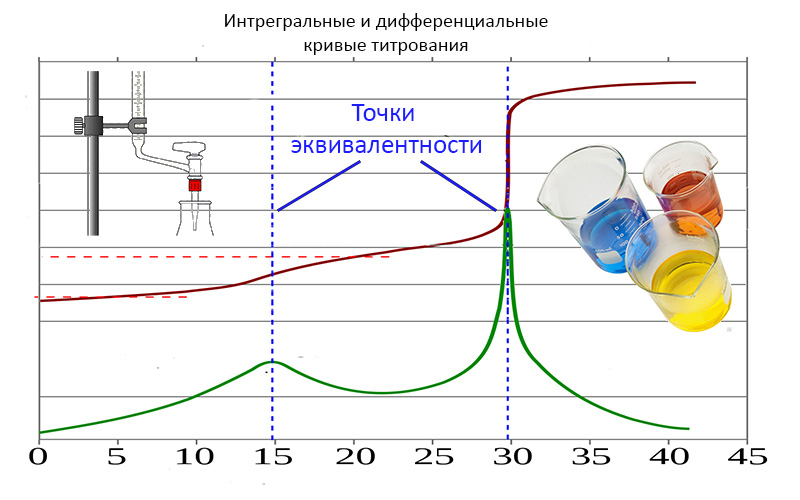
Момент, когда количество добавляемого титранта будет эквивалентно количеству определяемого вещества, называется точкой эквивалентности.
В зависимости от типа химической реакции мера эквивалентности может привязываться к различным частицам:
-
Для ионнообменных процессов – это ион водорода H+.
-
В случае окислительно-восстановительных реакций единицей эквивалентности служит электрон.
Виды титрантов
Название метода произошло от слова титр (франц. качество, характеристика) – концентрации, являющейся количественной характеристикой рабочего раствора, добавляемого к определяемому раствору. Титр титранта должен быть известен заранее, и способ его определения зависит от того, каким образом был приготовлен рабочий раствор.
Титр рабочего раствора обычно выражается как отношение массы (г) растворенного вещества к объему приготовленного раствора (мл) и может быть рассчитан по формуле:
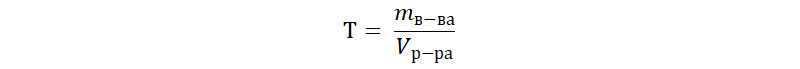
Где,
Т – титр титранта;
mв-ва – масса растворенного вещества;
Vр-ра – объем титрованного раствора.
Титр раствора взаимосвязан с другими видами концентраций, которые также широко используются в количественном анализе: молярной, нормальной, массовой долей растворенного вещества, моляльной. Существуют формулы перерасчета, которые позволяют перейти к любой из них.
В зависимости от способа приготовления различают два вида рабочих растворов:
-
стандартный раствор с приготовленным титром (первичный стандартный раствор);
-
стандартный раствор с установленным титром (стандартизированный раствор).
Первичный стандартный раствор
Для приготовления раствора с известным титром необходимо взять химически чистое вещество с известной формулой, стабильное в твердом и жидком состоянии. Реагенты, которые обладают такими характеристиками, называют стандарт-титрами, фиксаналами или первичными стандартами. Взвесив навеску с точностью до 4-го знака, вещество растворяют в известном объеме растворителя (воды), получая раствор известной концентрации. У таких титрантов поправочный коэффициент к концентрации считается равным 1.00, их можно использовать для стандартизации вторичных растворов.
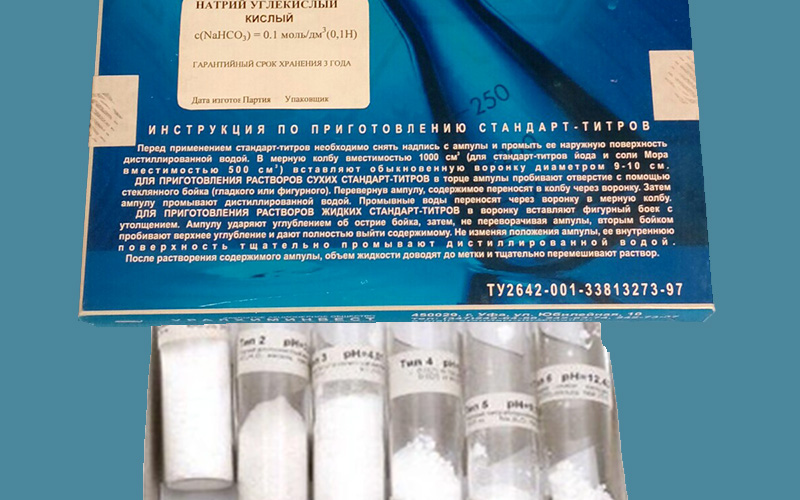
Стандарт-титр (фиксанал)
Вторичный стандартный раствор
Если титрант с точно известной концентрацией приготовить сразу нельзя, то в этом случае готовят раствор с приблизительной точностью. В дальнейшем его стандартизируют с помощью первичных растворов известной концентрации. Полученный таким образом титрант, называют вторичным стандартным раствором. В некоторых случая стандартизацию проводят не первичным, а другим вторичным раствором с известной концентрацией. Поправочный коэффициент стандартизированных титрантов отличается от единицы, но должен укладываться в диапазон от 0,9 до 1,1.
По своей сути поправочный коэффициент показывает отклонение приготовленного раствора от теоретической концентрации, которую предполагалось получить при смешивании исходных компонентов.
Как понять, что титрование окончено, и какие химические взаимодействия лежат в основе титриметрического анализа, какие еще необходимы реактивы для титрования можно посмотреть в наших последующих материалах.